Beim Lambert-beer‘schen Gesetz geht es um den die Abschwächung der Intensität eines Lichtstrahles aufgrund der konzentrationsabhängigen Interaktion mit Molekülen. Auf diesem Grundsatz baut die gesamte photometrische Analytik auf. Diese ist eine der am weitesten verbreiten Analysentechniken. Wie stark der Lichtstrahl abgeschwächt wird, hängt auch vom molekularen Aufbau der Verbindungen ab. Aus diesem Grund gibt es auch einen wellenlängenabhängigen und molekülspezifischen Extinktionskoeffizienten, um aus einer Messgröße (Absorption/Extinktion) eine Probenkonzentration berechnen zu können. Aber fangen wir nun zuerst von Vorne an. In der Darstellung unterhalb sieht man das grundlegene Prinzip: ein Lichtstrahl verliert an Intensität, wenn er auf Moleküle trifft und dort einen Teil seiner Energie abgibt. Diese Abschwächung der Intensität kann man nun zur Bestimmung der Konzentration und teilweise der Indentität einer Probe verwenden.
Abbildung 1: grober schematischer Aufbau eines Photometers

Zuerst etwas Geschichtliches: die ersten Zusammenhänge hierzu wurden von Pierre Burger 1729 beschrieben. Johann Heinrich Lambert baute dann auf diesen Arbeiten auf. Zu der finalen weiter untenstehenden Formel kam es erst 1852 durch August Beer. Es ist ein schönes Beispiel dafür, das selbst für scheinbar einfache Formeln und Zusammenhänge die Arbeit mehrerer Experten notwendig ist und es trotzdem Jahrzehnte, oder hier sogar hier mehr als 100 Jahre gedauert hat, bis man zu einem verwendbaren Ergebnis gekommen ist.
Abbildung 2: Was Licht auf seinem Weg so widerfährt: Es wird entweder reflektiert (wie in einem Spiegel), es tritt durch das Medium durch (Transmission, wie bei einer Fensterscheibe) oder es wird im Medium absorbiert (wie der blaue und rote Anteil vom Sonnenlicht, wenn es auf Chlorophyll trifft). Die Streuung des Lichtstrahls im Medium wird meist ignoriert und ist hier auch nicht dargestellt.

Bei der Extinktion geht es um Absorption (also wieviel Energie wird von der Probe aufgenommen) und um Streuung (also die Ablenkung eines Teils der Lichtstrahlen an der Probe selbst). Wie schon erwähnt, wird die Steuerung meist vernachlässigt und man setzt daher die Extinktion der Absorption gleich. In der Photometrie nehmen wir an, dass das gesamte Licht in die Küvette eindringt (also, dass nichts an der Oberfläche reflektiert wird). Tja und Transmission ist schließlich das, was wir messen. Sprich wieviel Licht kommt beim Detektor an.
Bei der Formel unterhalb geht es nur darum, dass Extinktion die Abschwächung von Licht in Zehnerintervallen ausdrückt. Beispiel: wenn man eine Fensterscheibe hat und die Lichtintensität bei, sagen wir mal bei einer Wellenänge von 400 nm misst und feststellt, dass 90 % der Lichtintensität durch die Schiebe durchgehen, erhält man eine Extinktion von 0.0457. Bei einer anderen Wellenlänge (z.B.: 250 nm) kommt fast kein Licht durch die Fensterschreibe, da hier das ultraviolette Licht (glücklicherweise)sehr stark absorbiert wird (also keine Sonnenbrandgefahr im Wohnzimmer). Die Extinktion (bzw. Absorption) ist somit immer von der jeweiligen Wellenlänge abhängig. Wer sich nun fragt, warum das dann mit Glasküvetten in der Photometrie funktioniert: hier wird Quarzglas (SiO2) verwendet. Dieses lässt UV Licht bis zu einer Wellenlänge von mind. 200 nm fast ungehindert durch.
Formel 1: Wie berechnet man die Extinktion aus der Abschwächung des Lichtstrahls
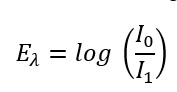
Eλ Extinktion bei der jeweiligen Wellenlänge [eigentlich keine Einheit da es nur Verhältniszahl ist, in der Praxis jedoch oft AU für Absorption Units verwendet]
I0 Intensität des eingestrahlten Lichts (bzw. Intensität des Lichts am Detektor, wenn es nicht durch die Probe geleitet wird) [W/m²]
I1 Intensität des transmittierten Lichts (bzw. Intensität des Lichts am Detektor, wenn es durch die Probe geleitet wird) [W/m²]
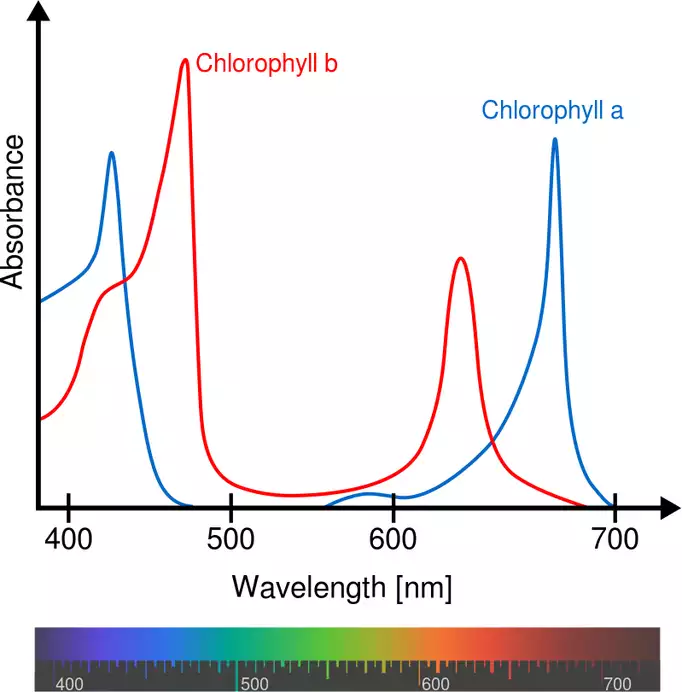
Abbildung 3: Beispiel von Absorptionsspektren von Chlorophyll. Spektren stellen den Zusammenhang der Absorption über die Wellenlänge dar. Je geringer die Wellenlänge desto bläulicher wird das Licht, je höher die Wellenlänge umso rötlicher wird es. Im Bereich 500 – 600 nm sieht man die grüne Lücke. Das nicht absorbierte Licht wird reflektiert und kann von unseren Augen wahr genommen werden >> was auch der Grund ist, warum Pflanzen für uns grün erscheinen.
Mit der Formel von vorhin allein fängt man jedoch in der Praxis noch nicht viel an. In der Formel unterhalb sieht man, dass die Extinktion von dem molekularen Extinktions-Koeffizienten abhängt, von der Konzentration der Probe und von der Länge des Lichtpfades durch die Probe (oft auch als Schichtdicke einer Photometerküvette bezeichnet)
Formel 2: Wie kommt man von der Extinktion zur Konzentration des Analyten in der Probe
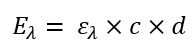
Eλ Extinktion bei der jeweiligen Wellenlänge [eigentlich keine Einheit da es nur Verhältniszahl ist, in der Praxis jedoch oft AU für Absorption Units verwendet]
ελ molekularer Extinktionskoeffizient des gesuchten Moleküls bei der jeweiligen Wellenlänge [m²/mol]
c Konzentration der Probe [mol/m³]
d Schichtdicke des durchstrahlten Körpers [m]
Wenn man nun beide Formeln gleichsetzt, erhält man eine Formel, mit der man in der Realität etwas anfangen kann. Die Abschwächung der Intensität auf der linken Seite kann man durch optische Sensoren messen. Wenn man nun auf der rechten Seite die Lichtpfadlänge in der Probe kennt und weiß aus was die Probe besteht (und damit in Tabellen nachschauen kann, welcher molekulare Extinktionskoeffizient verwendet wird) kann man sich die letzte verbleibende Variable c = Konzentration ausrechnen.
Formel 3: Und nun beide Gleichungen zusammengeführt: Wie kommt man von der Abschwächung des Lichts zur Konzentration der Probe.
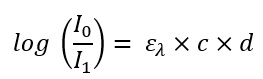
Ein Fakt, den man sich im Hinterkopf behalten sollte: bei einer Absorption (bzw. Extinktion) von 1 verbleibt 90 % der Energie vom Licht in der Probe. Bei einer Absorption von 2 ist es hinter der Probe bereits fast dunkel (es werden 99% des Lichts absorbiert). Für die Praxis heißt das, dass die Unterschiede in der Konzentration der Probe irgendwann nur mehr zu geringen Änderungen der Menge an absorbiertem Licht führen. Man kommt somit bei hohen Absorptionen in den nicht linearen Bereich bzw. in einem Bereich in denen die Messunsicherheiten stark zunehmen. Man sollte daher Messungen bis zu einer maximalen Absorption von 1.5 – 2.0 durchführen. Darüber hinaus sollte man die Probe verdünnen, oder eine Messzelle mit einem kürzen Lichtpfad nehmen.
Tabelle 1: Zusammenhang Transmission, Absorption
| Transmission (wieviel Licht geht durch die Probe, hier als Prozent angegeben) | Absorption (wieviel Energie vom Licht bleibt in der Probe, hier in Prozent angegeben) | gemessene Extinktion /Absorption |
| 90 % | 10 % | 0.045 |
| 10 % | 90 % | 1 |
| 1 % | 99 % | 2 |
| 0.1 % | 99.9 % | 3 |
Für Ergänzungen und auf Anregungen freuen wir uns auf Ihre E-Mail an office@labsupport.at
Autor: Dietmar Höbling
